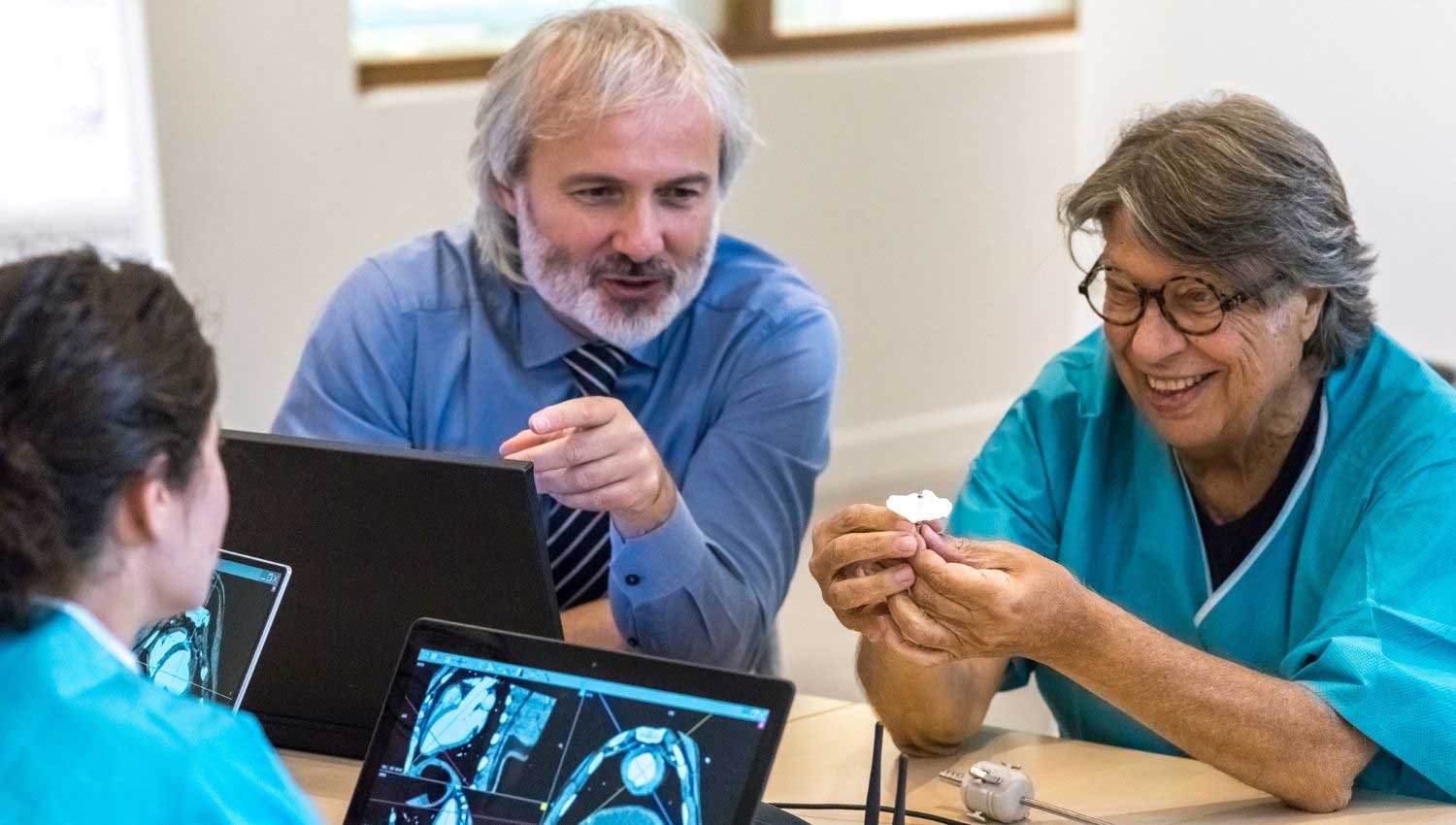
Intervista ad Eucardia
Eucardia è una PMI innovativa che opera nel settore Medtech e sta investendo sullo sviluppo di una tecnologia rivoluzionaria per la cura dello scompenso cardiaco.
Il mercato mondiale dei dispositivi medici cardiovascolari vale oltre 40 miliardi di dollari l’anno ed è il più importante nel Medtech poiché trainato dalle crescenti spese legate all’aumento della popolazione anziana e dalla domanda di trattamenti sempre meno invasivi.

Gli investimenti
Gli investimenti in società che sviluppano tecnologie innovative per la cura delle persone richiedono pazienza. Il tempo di sviluppo per portare un prodotto dalla ricerca di base al mercato a volte supera anche i dieci anni, perché è necessario affrontare prove che ne garantiscano sicurezza ed efficacia clinica. Il ritorno può però essere ragguardevole e ripagare abbondantemente l’attesa.
Le aziende Medtech con maggior successo sono quelle che individuano bisogni clinici insoddisfatti, sviluppano soluzioni specifiche basate su una forte proprietà intellettuale, hanno un solido management team, e operano in mercati di grandi dimensioni con elevati margini prospettando, al tempo stesso, un contenimento della spesa da parte dei sistemi sanitari.
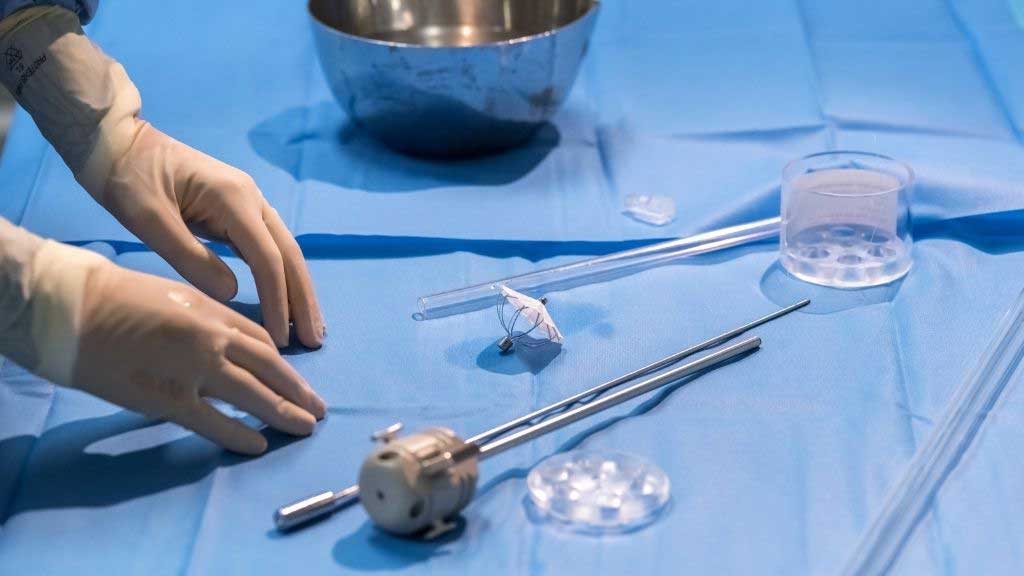
Il dispositivo brevettato da Eucardia: Heart Damper
Innovare nel settore della salute significa migliorare l’accesso all’assistenza sanitaria, prevenire e alleviare le sofferenze, e, in molti casi, salvare vite umane.
A rifletterci su, non esiste altra missione con obiettivi così alti.
Siamo più che mai consci di quanto la vita sia preziosa e della natura limitata delle nostre risorse, incluso il capitale, e gli atteggiamenti socialmente consapevoli si estendono sempre più anche alle decisioni di investimento.
Per chi ha orizzonti di medio-lungo termine, investire nel lavoro di Eucardia offre un’opportunità in cui la ricerca di una forte redditività incontra coscienza e responsabilità sociale.
A tu per tu con Eucardia: intervista a Marco Bottaro
Cosa differenzia un’azienda Medtech dalle altre Startup e perché secondo te vi è una regolamentazione diversa?
Un’azienda che opera nel settore medtech si occupa di prodotti che vengono definiti “dispositivi medici” che sono classificati a seconda dell’interazione con il corpo umano. Nella maggior parte dei casi si tratta di prodotti a scopo terapeutico ed è necessario quindi rispettare un preciso percorso regolatorio volto a garantire sicurezza ed efficacia per i pazienti.
Nel dettaglio quali sono le fasi di sviluppo prodotto che un’azienda come Eucardia deve affrontare prima di poter commercializzare il prodotto?
Dopo le prime fasi di concettualizzazione prodotto siamo passati alla fase di prototipazione e test iterativi su differenti piattaforme sperimentali con l’obiettivo di ottimizzare le caratteristiche di prodotto (design optimization).
Ora dobbiamo completare la fase di sviluppo prodotto per congelare le specifiche tecniche e procedere con la fase di verifica e validazione pre-clinica (verification&validation) necessaria per ottenere l’autorizzazione ai primi impianti nell’uomo (first in human).
La fase seguente consisterà poi nella validazione clinica vera e propria volta ad ottenere il marchio CE per poter commercializzare il prodotto in Europa e l’approvazione FDA per il mercato USA. Lungo tutto questo percorso è ovviamente importante il continuo confronto collaborativo con specialisti interventisti e clinici.

Marco Bottaro CEO di Eucardia durante l’evento Meet the CEO
Quali sono le prove che garantiscono sicurezza ed efficacia clinica?
Le prove che dimostrano sicurezza ed efficacia di un dispositivo medicale devono seguire e rispettare delle precise Normative e Standards. Queste prove sono piuttosto stringenti fin dalla prima fase di sviluppo del prodotto e consistono nel sottoporre il prodotto sia a test biologici in-vivo e in-vitro (come ad esempio citotossicità, emocompatibilità, carcinogenicità, ed altri), sia a test meccanici come, ad esempio, resistenza a fatica.
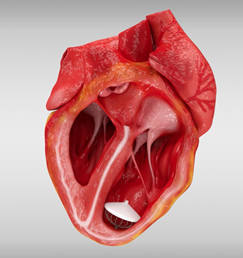 Il nostro dispositivo, ad esempio, è progettato per essere impiantato nel ventricolo sinistro del cuore e cambiare la propria conformazione in sincronia con il ciclo cardiaco (il più noto “battito”). Semplificando al massimo, possiamo immaginarlo come una molla che si contrae e rilascia ad ogni ciclo. Un cuore batte circa 40 milioni di volte all’anno e se vogliamo garantire una durata prodotto di 5 anni dobbiamo dimostrare che resiste a fatica per 200 milioni di cicli. Tutto ciò è reso possibile grazie al nostro know-how medicale e ingegneristico, all’utilizzo di particolari materiali biocompatibili e deformabili per la realizzazione del prodotto, e alla capacità di progettare ed eseguire prove accelerate a fatica su apparecchiature da banco.
Il nostro dispositivo, ad esempio, è progettato per essere impiantato nel ventricolo sinistro del cuore e cambiare la propria conformazione in sincronia con il ciclo cardiaco (il più noto “battito”). Semplificando al massimo, possiamo immaginarlo come una molla che si contrae e rilascia ad ogni ciclo. Un cuore batte circa 40 milioni di volte all’anno e se vogliamo garantire una durata prodotto di 5 anni dobbiamo dimostrare che resiste a fatica per 200 milioni di cicli. Tutto ciò è reso possibile grazie al nostro know-how medicale e ingegneristico, all’utilizzo di particolari materiali biocompatibili e deformabili per la realizzazione del prodotto, e alla capacità di progettare ed eseguire prove accelerate a fatica su apparecchiature da banco.
Per ciò che concerne l’efficacia, sebbene alcune evidenze preliminari possano essere raccolte durante gli studi pre-clinici in-vivo, solo con gli studi clinici a partire dal first in human sarà possibile procedere con le dovute osservazioni e valutazioni mediche post-impianto nel tempo.
È quindi durante la validazione clinica nell’uomo che sicurezza ed efficacia clinica vengono definitivamente comprovate su molti pazienti, come avviene del resto per i farmaci, prima di ottenere il via libera alla commercializzazione dagli enti regolatori e dalle autorità sanitarie preposte.
Quali step che considerate più “ostici” Eucardia ha superato con orgoglio?

Test pre clinico in-vivo
Finora, sicuramente le prime prove che abbiamo condotto su modelli sperimentali in-vivo. Osservare il nostro prodotto all’interno di un cuore battente comportarsi come ci aspettavamo è stata una forte emozione.
Perché investire sul Medtech ha un rischio elevato ma un ritorno altissimo? Può essere importante il fatto che sia un settore governato dalle principali aziende mediche mondiali? Cosa succede solitamente alle startup medicali di successo? Hai un esempio da fare?
Quando si parla di rischio elevato può insorgere un grosso equivoco che va chiarito. Non si tratta di un gioco d’azzardo: tutt’altro.
Lavoriamo in un contesto professionale molto qualificato in cui risk assessment e risk management sono pane quotidiano.
Le tematiche e le variabili da prendere in considerazione sono numerose e gli standard da rispettare molto alti, ed è questo intenso lavoro che richiede tempi lunghi di sviluppo e assorbe ingenti capitali. Maggiori dettagli sono contenuti nel nostro prospetto informativo.
Il mercato Medtech è dominato da un numero limitato di multinazionali che sono molto attive sul fronte M&A secondo una logica che risponde all‘esigenza di rimanere al passo con i continui progressi tecnologici in modo più flessibile e rapido di quanto sarebbe realizzabile attraverso una ricerca e sviluppo interna.
È ciò che potrebbe accadere a noi in un prossimo futuro, nel momento in cui decideremo che i nostri assets sono maturi per aprire a un partner strategico in ottica di licensing o di vendita.
Per ciò che concerne il ritorno sull’investimento, i valori in campo dipendono principalmente dal mercato sottostante, dalle sinergie su portafoglio prodotti e posizionamento di mercato e, ovviamente, dallo stadio di sviluppo raggiunto dalla target.
Un esempio di successo significativo nell’ambito cardiovascolare a noi vicino è rappresentato da una serie di acquisizioni avvenute qualche anno fa da parte di majors come Medtronic, Abbott e Edwards di società target con tecnologie innovative per la valvola mitralica, a valori compresi fra i 250 e i 400 milioni di dollari al first in human con 50-150 milioni di dollari aggiuntivi al raggiungimento di successive milestones (validazione clinica CE/FDA).
Il nostro mercato di riferimento, l’insufficienza cardiaca di tipo sistolico, è molto più grande, ha al momento meno concorrenti attivi, ed è un tasto assai più dolente per i budget dei sistemi sanitari poiché la gestione dei pazienti è particolarmente onerosa. Ci attendiamo dunque un fortissimo interesse in prospettiva da parte di tutti gli stakeholders coinvolti.